
Нейрофизиологические механизмы выхода мелких лабораторных животных из гипометаболических состояний (материалы диссертации к.б.н. Шило А.В.)

Способность некоторых млекопитающих самопроизвольно погружаться в гипометаболические состояния удивительна сама по себе и является предметом многолетних фундаментальных исследований. Известно, что животные в подобных состояниях устойчивы к гипотермии, гипоксии, ишемии, реперфузионному повреждению органов и тканей, невосприимчивы к инфекциям, травматическим поражениям мозга, облучению, развитию раковых опухолей и нейродегенеративных заболеваний.
Существует мнение, что создание управляемого искусственного гипометаболизма (подобного зимней спячке (гибернации) даст возможность медицине бороться с такими проблемами, как ишемическое и реперфузионное повреждение тканей организма, лихорадка, травматические поражения мозга. Кроме того, искусственные гипометаболические состояния (ИМГС) могут быть использованы для создания необходимых уровней гипотермии при хирургических вмешательствах и в трансплантологии для улучшения протоколов хранения органов, тканей и клеток. Следует однако отметить, что успехи в достижении необходимого уровня гипометаболизма у негибернирующих животных на сегодняшний день весьма скромны, а для достижения ИГМС используют потенциально опасные факторы (гипоксия, гиперкапния, гипотермия, газовые смеси (содержащие, как правило, кислород и углекислый газ в различных пропорциях), H2S и др., реакции ЦНС и ССС на которые остаются до конца не выясненными.
Для выявления особенностей реагирования гибернирующих и негибернирующих животных на комбинацию факторов (гипоксия, гиперкапния, охлаждение), приводящих к развитию ИГМС, был проведен сравнительный анализ динамики изменения активности сердца при погружении в состояние искусственной гибернации и выходе из него (работа выполнена совместно со с.н.с. Ломако В.В.).
Показано, что достигаемое с помощью комбинированного действия гипоксии, гиперкапнии, холода и темноты ИМГС характеризовалось как минимум 2 сценариями изменения активности сердца как у гибернирующих (золотистый хомячок, Mesocricetus аuratus), так и у негибернирующих (крыса) животных: при 1-м (с низким значением коэффициента вариации (CV) длительности кардиоинтервалов (КИ) происходит постепенное увеличение величины КИ при охлаждении и такое же плавное их уменьшение при самопроизвольном разогреве; при 2-м (с высоким значением CV длительности КИ) - охлаждение приводит к развитию бимодального распределения КИ (чередующиеся длинные и короткие кардиоинитервалы). Интервал времени, при котором значением CV длительности КИ повышен у гибернирующих животных значительно короче, чем у негибернирующих и заканчивается в кратчайшие сроки после снятия гипоксии-гиперкапнии. По направленности и скорости последующего самопроизвольного отогрева животных практически не различались.
Непрерывная регистрация длительности КИ сокращающегося сердца пробуждающихся от зимней спячки золотистых хомячков также позволила выделить по крайней мере 2 группы животных, отличающихся друг от друга динамикой повышения частоты сердечных сокращений (ЧСС). У 1-й группы повышение ЧСС происходило равномерно с отсутствием или слабовыраженной аритмией в течение всего периода выхода из зимней спячки. У 2-й - при достижении уровня защечной температуры 12-16oС отмечалась выраженная аритмия длительностью от 15 до 40 мин. Начальный и конечный периоды восстановления сердечной активности в группах животных не отличались. Практически одинаковая частота следования ударов сердца и дыхания животных в период появления аритмий не позволяет отнести этот феномен на счет дыхательной аритмии сердца.
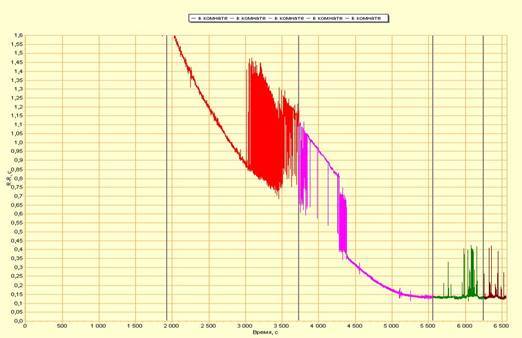
Динамика изменения длительности кардиоинтервалов пробуждающегося от спячки хомячка.
При угнетении метаболизма могут происходить разнонаправленные изменения в скорости ферментативных реакций, процессах распада и синтеза белков. В реализации этих процессов особую роль играют протеолитические ферменты, которые не только участвуют в гидролизе белковых молекул до аминокислот, но и образуют активные формы ферментов из неактивных предшественников (ограниченный протеолиз). Обладая высокой активностью, протеолитические ферменты могут представлять и потенциальную опасность для белковых структур органов и тканей, поэтому наличие специфических ингибиторов протеолиза является одним из важных, хотя и не единственным, способом контроля активности протеиназ.
Показано, что ИГМС приводит к разнонаправленному изменению показателей протеолитической активности: общая протеолитическая активность незначительно повышалась, альфа-1-ингибитор протеиназ оказался устойчивым, тогда как нетрипсиноподобные протеиназы и альфа-2-макроглобулин проявили высокую чувствительность к факторам, вызывающим ИГМС. Отогрев животного в течение 2 ч после развития ИГМС способствует повышению активности протеиназ в тканях мозга, что указывает на интенсификацию реакций ограниченного протеолиза и расходование альфа-1-ингибитора протеиназ, возможно, обусловленное накоплением дефектных молекул, синтезом белков теплового шока и его связыванием с ними и контролирование избыточной активности протеиназ с помощью альфа-2-макроглобулина. Однонаправленная тенденция к нормализации активности протеолитических ферментов и их ингибиторов отмечается через 24 ч после ИГМС, что может свидетельствовать о завершении репаративных процессов в организме (работа выполнена со с.н.с. Ломако В.В. и с.н.с. Самохиной Л.М. ГП "Институт Терапии им. Л.Т. Малой АМН Украины").
Существует гипотеза, согласно которой в период естественного сна происходит восстановление "резервного" потенциала клеток. Причем, в период так называемого медленноволнового сна (МВС) происходят анаболические процессы во всем организме, включая головной мозг, а в период так называемого парадоксального сна (ПС) - синтетические процессы преимущественно в ЦНС.
Длительное отсутствие ПС, обнаруженное нами у крыс при выходе из ИГМС, может указывать на то, что в первую очередь организм нуждается в восстановлении не структурных, чему способствует ПС, а функциональных белков, синтез которых происходит в МВС. В этой связи, можно предположить, что кратковременное компенсаторное увеличение сна, развивающееся в течение первых часов после выхода из ИГМС, согласно гипотезе об анаболической роли сна, способствует интенсификации восстановительных процессов как в ЦНС, так и в организме. Кроме того, МВС может играть значимую роль в восстановлении температурного гомеостаза. Структура и цикличность сна восстанавливается в течение 24 ч. При этом ИГМС не приводит к стойким продолжительным изменениям в цикле сон-бодрствование и не влияет на суммарную длительность сна в течение суток (работа выполнена совместно с асп. Венцковской Е.А.).
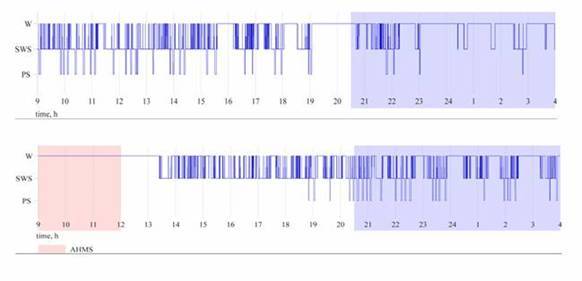
Примеры сомнограмм (последовательность чередования фаз бодрствования и сна во времени): верхний рисунок - контрольная крыса, нижний - крыса после ИГМС (AHMS); W - бодрствование, SWS - медленноволновой сон (МВС), PS - парадоксальный сон (ПС): розовое затенение - период ИГМС, синее затенение - темное время суток.


Институт проблем криобиологии и криомедицины НАН Украины
Тел: (+38 057) 373-41-43, 373-38-07, 373-30-39; Факс: (+38 057) 373-30-84
E-mail: cryo@online.kharkov.ua